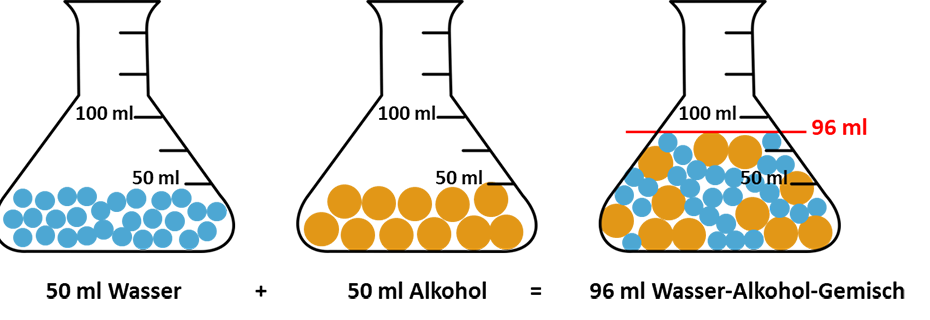In der Schule lernen wir bereits in der 1. Klasse: 1 + 1 = 2. Aber in der Chemie ist dies nicht immer so! Denn wenn man einen Liter Alkohol und einen Liter Wasser zusammenschüttet, erhält man nicht zwei Liter, sondern etwas weniger. Schuld daran ist die Volumenkontraktion (Volumenverminderung)!
Was steckt hinter der Volumenkontraktion?
Bei der Vermischung von Alkohol mit Wasser wird das Volumen kleiner, weil zwischen den Molekülen starke Wechselwirkungen auftreten. Es kommt zur Ausbildung zusätzlicher Bindungskräfte zwischen den Alkohol- und den Wasser-Molekülen, beispielsweise durch van-der-Waals-Kräfte oder Wasserstoffbrückenbindungen, welches zur Folge hat, dass alle Moleküle näher „zusammenrücken“.
Es bilden sich also sogenannte Assoziate, die eine höhere Dichte aufweisen sowie eine höhere Viskosität als die restliche Lösung. Da Alkohol-Moleküle größer sind als Wassermoleküle, haben sie größere Zwischenräume zwischen ihren Molekülen. In diese Zwischenräume können dann die kleineren Wassermoleküle rutschen. Dies wird durch die zusätzlichen Bindungen unterstützt. Das Volumen wird kleiner!
Gibt man zum Beispiel 50 ml Alkohol in 50 ml Wasser so erhält man ein Gesamtvolumen von 96 ml.
Dieser Unterschied ist nicht wirklich riesig und somit auch nicht mit dem bloßen Auge in einem Glas zu sehen, aber misst man die Flüssigkeiten anhand einer Skala, beispielsweise mit einem Standzylinder, korrekt ab, kann man dieses Phänomen tatsächlich nachvollziehen!
Wer sich das ganze einmal live ansehen möchte, der kann das mit folgendem Experiment tun:
https://www.phywe.de/de/volumenkontraktion-von-fluessigkeiten.html
Die Volumenkontraktion ist nichtlinear vom Mischungsverhältnis abhängig!
Da die Volumenkontraktion nicht linear vom Mischungsverhältnis abhängig ist, kann man den Alkoholgehalt von Mischungen nur über die Dichte oder den Siedepunkt bestimmen, aber nicht über das Volumen.
Die Dichte von Alkohol und Wasser
Die Dichte von Flüssigkeiten, Festkörpern und Gasen ist abhängig von Temperatur und Druck.
Bei einer Raumtemperatur von 20°C und normalem Luftdruck hat Trinkalkohol eine Dichte von 0,79 g/cm3 und Wasser eine Dichte von 1 g/cm3. Alkohol ist somit bei gleichem Volumen leichter als Wasser!
Welches Gewicht hat ein Liter Alkohol?
Das Gewicht bzw. die Masse (m) ist definiert als die Dichte (d) multipliziert mit dem Volumen (V).
m = d · V
Dichte (d) von Alkohol = 0,79 g/cm3
Volumen (V) = 1 L = 1.000 ml = 1.000 cm3
0,79 g · 1.000 cm3 = 790 g
Die richtige Angabe des Alkoholgehalts in Mischungen
Die Dichte des Alkohols ist im Vergleich zu der Dichte der anderen Zutaten in Getränken/Mischungen, die meist bei 1 kg/l oder höher liegt, geringer. Das Gesamtvolumen ist geringer als die einzelnen Volumina (siehe Abbildung). Dadurch sind die einzelnen Volumenanteile der Lösung am Gesamtvolumen prozentual höher. Um den Alkoholgehalt in der richtigen Relation/Menge zum Gesamtvolumen anzugeben, muss dieser immer in Volumenprozent (Vol.-% oder % Vol.) angegeben werden. Volumenprozent ist der volumenmäßige Anteil einer Substanz bezogen auf das Gesamtvolumen eines flüssigen Gemisches.
Bei einer Angabe eines Alkoholgehaltes von 11 % Vol., zum Beispiel bei Sekt, heißt das, dass 11 % des gesamten Volumens aus reinem Alkohol besteht. Eine Sektflasche mit einem Volumen von 750 ml würde demnach 82,5 ml Alkohol enthalten.
Wer ein bisschen herumrechnen möchte, der kann das hier tun:
https://rechneronline.de/volumenprozent-massenprozent/
Weiterführende Informationen finden Sie hier:
- https://www.alkohol-lexikon.de/ALCOHOL/AL_GE/volumenkontraktion.shtml
- https://www.spektrum.de/lexikon/chemie/volumenkontraktion/9827
- https://physik.cosmos-indirekt.de/Physik-Schule/Volumenkontraktion
- https://www.diepta.de/news/praxis/wissen-sie-es-noch-52-48-963-553744/
- http://www.helpster.de/dichte-von-ethanol-informatives_192391
- https://www.chemie-schule.de/KnowHow/Volumenprozent